
El oxígeno (O) es un elemento químico no metálico, normalmente gaseoso, sumamente abundante en nuestra atmósfera (íntegra el 20,8% de su volumen actual) en su forma molecular (O2) y el tercero más abundante del universo (luego del hidrógeno y el helio). Es indispensable para la vida tal y como la conocemos, en especial por su capacidad para formar junto al hidrógeno la molécula de agua (H2O).
Es muy reactivo, por lo que no suele encontrarse en su estado elemental (O), sino formando moléculas compuestas por sus mismos átomos o constituyendo compuestos químicos con otros elementos. La molécula de oxígeno es usualmente diatómica (O2) a presión y temperatura ambiente o triatómica (ozono O3) bajo condiciones ambientales específicas. Como posee una reactividad muy elevada, se encuentran átomos de este elemento en numerosos compuestos orgánicos e inorgánicos del planeta, en los diversos estados de agregación de la materia. Se trata, pues, de un elemento sumamente común en el mundo y el universo conocido.

En la Tabla Periódica el oxígeno se halla al inicio del grupo 16 (VIA), entre los elementos no metálicos. Se representa con la letra O y en ese grupo está seguido por el azufre (S), el selenio (Se), el telurio (Te), el polonio (Po) y el livermorio (Lv). El oxígeno tiene el número atómico 8 y es el segundo elemento más electronegativo de la Tabla Periódica (el flúor es el más electronegativo). Es uno de los elementos que se encuentra en estado gaseoso en condiciones de presión y temperatura ambiente.
Este elemento químico se encuentra en el primer lugar y en la esquina superior izquierda de la tabla periódica, específicamente sobre el Litio. Se distingue a través de su símbolo atómico donde se marca con una H. Este forma parte de su propio grupo aunque suele estar ubicado dentro del Grupo 1 o familia IA.

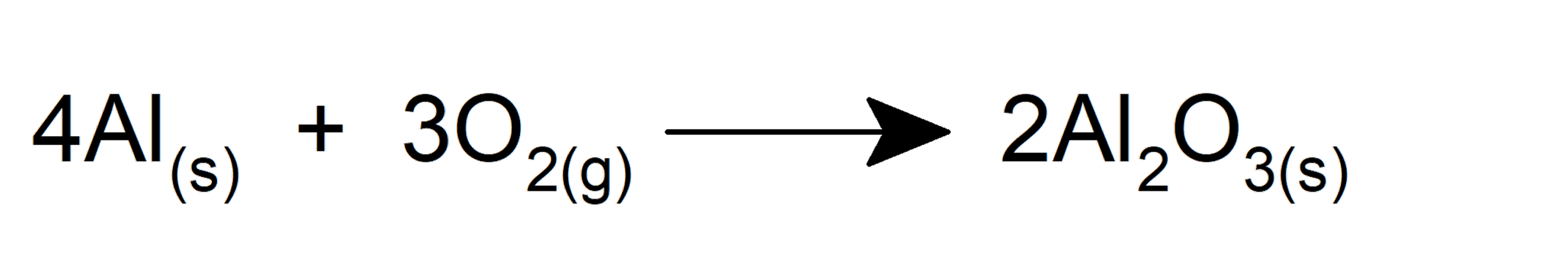
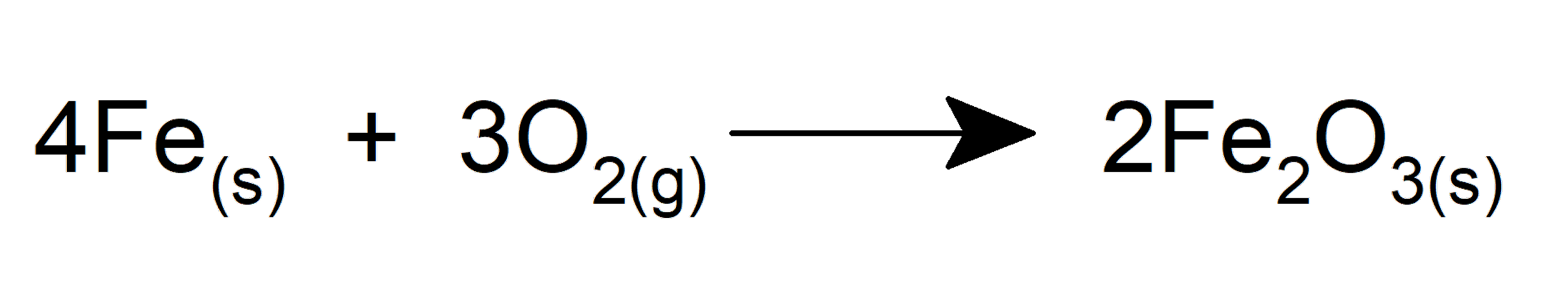
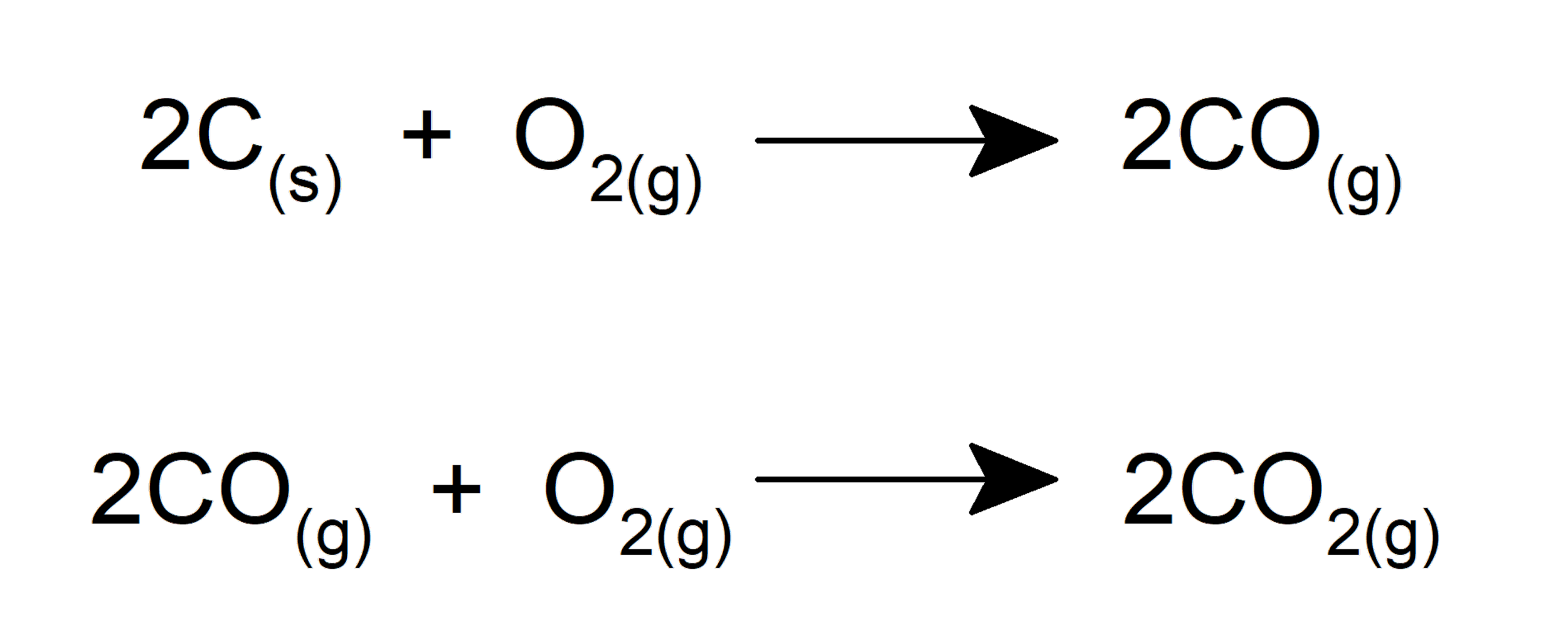
El oxígeno es fundamental en la vida. Forma parte de los azúcares y aminoácidos que componen las moléculas esenciales biológicas: carbohidratos, proteínas, grasas, etc. Además, constituye parte de las moléculas esenciales para el transporte de energía en el organismo de los seres vivos (ADP y ATP). Por otra parte, el oxígeno es fundamental para la realización de la fotosíntesis de las plantas, las algas y ciertas bacterias.
La producción industrial del oxígeno se da principalmente a través de dos métodos: