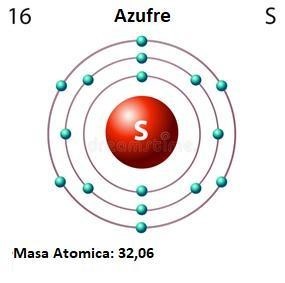
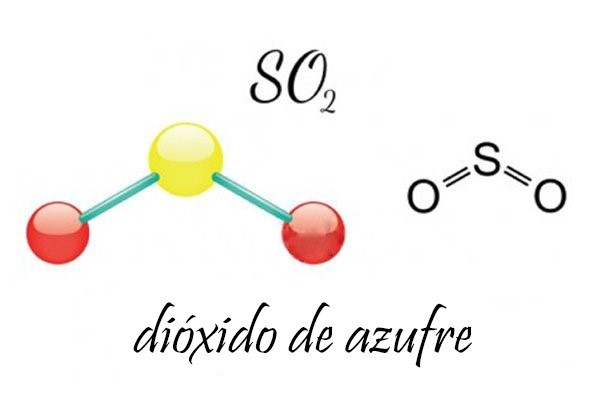
El azufre es un elemento químico de número atómico 16 y símbolo S. Es un no metal abundante con un color amarillo característico. Dicho elemento es generado en estrellas masivas en las que predominan temperaturas que provocan la fusión entre un núcleo de silicio y otro de helio en un proceso denominado nucleosíntesis de supernovas. El azufre se encuentra en forma nativa en regiones volcánicas y en sus formas reducidas formando sulfuros y sulfosales o bien en sus formas oxidadas como sulfatos. Es un elemento químico esencial constituyente de los aminoácidos cisteína y metionina y, por consecuencia, necesario para la síntesis de proteínas presentes en todos los organismos vivos. Se usa principalmente como fertilizante, pero también en la fabricación de pólvora, laxantes, fósforos e insecticidas. Este no metal tiene un color amarillento fuerte, amarronado o verde anaranjado y arde con llama de color azul, desprendiendo dióxido de azufre (SO2). Es insoluble en agua, pero se disuelve en disulfuro de carbono y benceno (CS2 y C6H6). Es multivalente, y sus estados de oxidación comúnmente son: -2, +2, +4, +6. En todos los estados (sólido, líquido y gaseoso): según los químicos presenta formas alotrópicas cuyas relaciones no son completamente conocidas. Las estructuras cristalinas más comunes son el octaedro ortorrómbico y el prisma monoclínico, siendo la temperatura de transición de una a otra de 96 °C. En ambos casos, el azufre se encuentra formando moléculas de S8 con forma de anillo, y es la diferente disposición de estas moléculas la que provoca las distintas estructuras cristalinas. A temperatura ambiente, la transformación del azufre monoclínico en ortorrómbico, es más estable y muy lenta. Al fundir el azufre, se obtiene un líquido que fluye con facilidad y que está formado por moléculas de S8. Sin embargo, si se calienta, el color se torna marrón algo rojizo, y se incrementa la viscosidad. Este comportamiento se debe a la ruptura de los anillos y la formación de largas cadenas de átomos de azufre que se enredan entre sí disminuyendo la fluidez del líquido. El máximo de la viscosidad se alcanza en torno a los 200 °C. Enfriando rápidamente este líquido viscoso se obtiene una masa elástica, de consistencia similar a la de la goma, denominada «azufre plástico» formada por cadenas que no han tenido tiempo de reordenarse para formar moléculas de S8. Transcurrido cierto tiempo la masa pierde su elasticidad cristalizando en el sistema rómbico
El azufre es conocido y utilizado desde la Antigüedad, y ya los egipcios lo empleaban para purificar los templos. Además, durante toda la Edad Media, los característicos olores de los gases sulfurosos que se desprendían de los volcanes, se llegaron a vincular con Satanás y las entradas a los infiernos subterráneos.
El azufre, al estar presente en grandes cantidades dentro de la corteza terrestre, se lo extrae mediante el proceso Frasch, el cuál consistente en inyectar vapor de agua sobrecalentado para fundir el azufre y así poder bombearlo al exterior utilizando aire comprimido.También se obtiene separándolo del gas natural, si bien su obtención anteriormente era a partir de depósitos de azufre puro impregnado en cenizas volcánicas.
Nombre: Azufre
Símbolo: S
Número: 16
Serie química: No metales
Grupo: 16
Masa atómica: 32,065 u
Configuración electrónica: 3s2 3p4
Apariencia: Amarillo
Estado a temperatura ambiente: Sólido
Punto de Fusión: 115°C
Punto de Ebullición: 445°C
Estructura cristalina: Ortorómbica
Isótopos:26S; 27S; 28S; 29S; 30S; 31S 32S (estable); 33S (estable); 34S (estable);35S; 36S (estable);
37S; 38S; 39S; 40S; 41S; 42S; 43S; 44S (estable); 45S (estable); 46S; 47S; 48S; 49S